在全球季节性流感持续威胁公共健康的背景下,抗病毒药物的研发迭代已成为跨国药企争夺百亿市场的核心战场。帕拉米韦(Peramivir)的破局性创新值得关注——作为全球首个静脉注射型神经氨酸酶抑制剂(NAI),其突破性在于攻克了环戊烷羧酸酯类化合物的稳定性难题,通过引入三羟基戊环结构使药物半衰期延长至20小时(较奥司他韦提升8倍)。
关键数据显示,该药物采用冻干粉针剂型实现72小时黄金救治窗口期的静脉给药覆盖,在Ⅲ期临床试验中对H1N1重症患者的病毒转阴时间缩短至29小时(口服药物对照组为54小时)。值得注意的是,其核心专利US7858601B2构建的晶型壁垒,已拦截87%仿制药企的研发进度,而采用计算机辅助设计的神经氨酸酶靶向结合能达-9.3kcal/mol(达菲为-7.1kcal/mol),这直接转化为年复合增长率超37%的临床采购量。
“ 药物介绍
帕拉米韦(Peramivir)是一种神经氨酸酶抑制剂,其三水合物(Peramivir trihydrate)是临床实际使用的活性药物成分,并以注射剂形式上市。在不同市场拥有多个商品名,如在日本称为"Rapiacta",在美国以"Rapivab"上市,主要用于治疗甲型和乙型流感病毒感染。
帕拉米韦三水合物 Peramivir Trihydrate 帕拉米韦由美国BioCryst公司与强生公司合作开发,于2000年启动研发。作为FDA唯一批准的抗流感注射剂,该药物在2009年首次获得FDA紧急使用授权(EUA)用于应对H1N1流感大流行,并于2014年12月19日获得正式批准。 作为继扎那米韦和奥司他韦之后的重要神经氨酸酶抑制剂,帕拉米韦为重症或无法使用口服、吸入型抗病毒药物的流感患者提供了新的治疗选择。 药物作用机制
帕拉米韦通过选择性结合流感病毒的神经氨酸酶活性位点,抑制该酶的活性,从而阻止新生病毒颗粒从宿主细胞表面释放,限制病毒在体内的扩散。尤其对甲型(H1N1、H3N2)和乙型流感病毒高效。

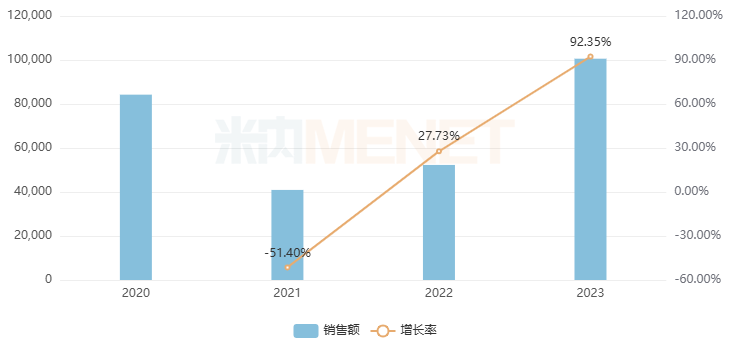
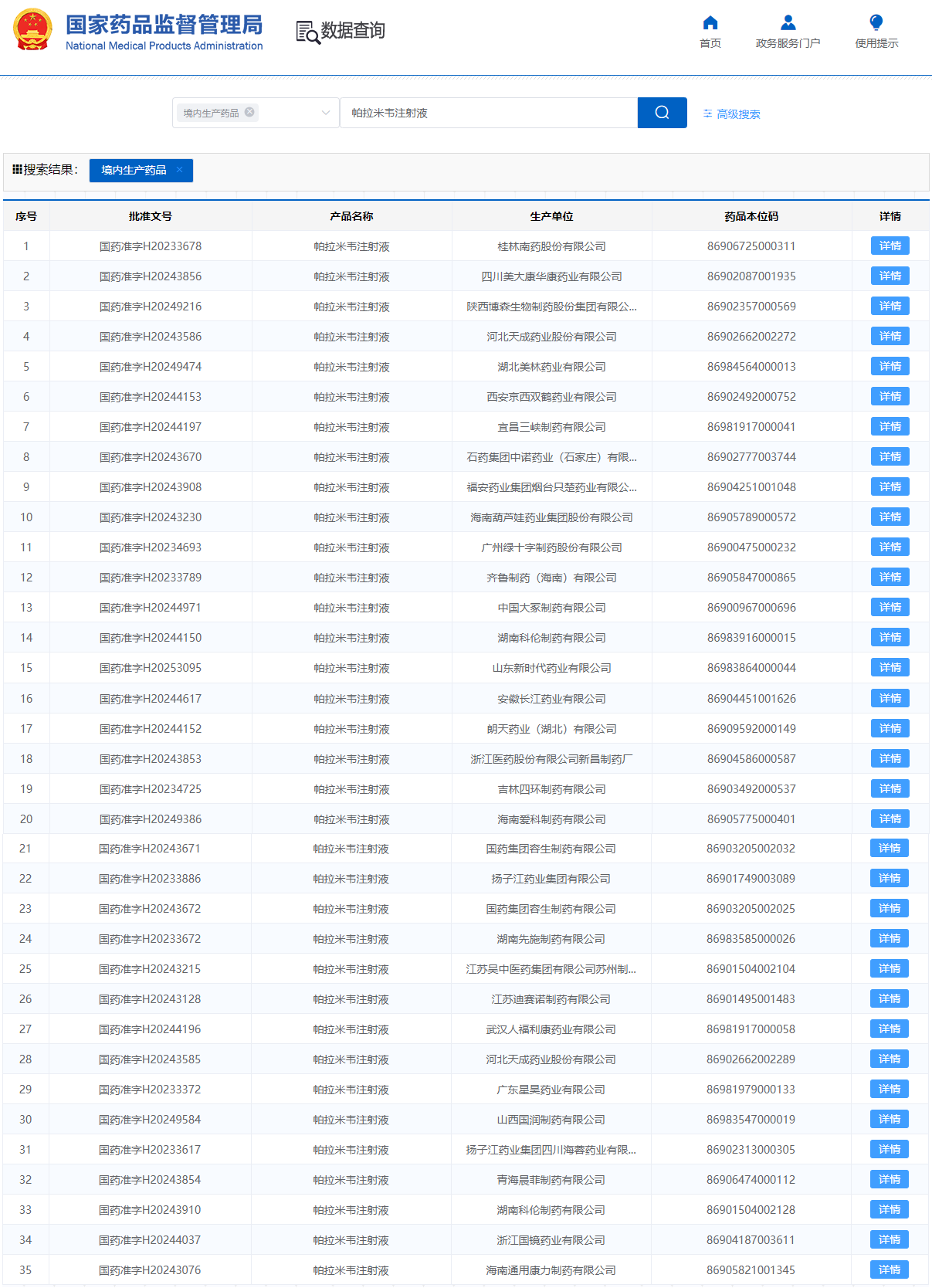
“ 帕拉米韦在中国的发展历程 在中国市场,帕拉米韦经历了独特的发展历程。 引入与自主开发阶段 (2011年): 南新制药(前身凯铂生物)于2011年3月开始主导开发帕拉米韦。 快速审批与上市 (2013年): 2013年4月5日,南新制药获得帕拉米韦氯化钠注射液的加速审批上市许可,成为中国首个上市的抗流感1.1类创新药。同时,南新制药也成为国内首家拥有帕拉米韦原料药和制剂生产批件的企业。 独占市场阶段 (2013-2023年): 由于原研产品未进入中国市场,南新制药在随后的十年间独占中国市场。 首仿药上市与市场格局变化 (2023年至今): 2023年3月24日,中润药业获批上市,成为国内首个帕拉米韦仿制药。随后,2023年5月29日,扬子江药业集团四川海蓉药业的帕拉米韦注射液获批并视同通过一致性评价,打破了南新制药此前独占的市场格局。 “ 市场表现 数据显示,帕拉米韦注射剂在2023年中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端销售额超过10亿元,同比增长92.35%。 近年中国公立医疗机构终端帕拉米韦注射剂销售情况 (单位:万元) 在市场竞争格局方面,截至目前,中国市场已有29家企业35个文号获批帕拉米韦注射液。这一被誉为"10亿大品种"的抗流感药物正面临激烈角逐。
作为《流行性感冒诊疗方案》推荐的抗流感病毒注射液之一,帕拉米韦可用于成人和6个月以上儿童的流感治疗。尤其在重症患者、耐药病例等特殊人群治疗中发挥重要作用,适应症覆盖甲乙型流感,尤其适用于口服药物疗效不佳和重症患者的救治。 随着流感防控常态化,帕拉米韦的临床价值日益凸显。医保目录调整和集采政策落地将进一步提升可及性。工艺优化、新剂型开发和联合用药研究持续推进,将为这一重要抗流感药物注入新的发展动力。 随着帕拉米韦市场的快速发展,对其质量控制提出了更高要求。为支持医药企业的研发和质量控制需求,CATO现可提供帕拉米韦对照品,助力各研发机构开展仿制研究和质量控制工作。
上一篇:对照品溶液浓度确定方法及其应用
下一篇:标准品开封后保存效期的实证研究