01 难治性CMV的现状
在全球每年约20万例成人移植病例中,CMV感染的发生率令人担忧。数据显示,实体器官移植受者的感染发生率为16-56%,而造血干细胞移植受者的感染发生率则高达30-70%。具体而言,49%的异基因造血干细胞移植患者和21%的实体器官移植患者术后会发生CMV感染,经治疗后,分别有32%和20%的患者会进展为难治性/耐药性感染。值得注意的是,CMV肺炎的病死率高达70%。据估算,仅2022年中国就有约2000余名移植后难治性/耐药性CMV成人患者。
传统治疗方案如更昔洛韦、缬更昔洛韦、膦甲酸钠存在严重局限。这些药物不仅疗效有限,还具有显著的毒副作用。其中,(缬)更昔洛韦会显著增加骨髓抑制风险,而膦甲酸钠则会大幅增加肾毒性风险。患者常因这些不良反应而不得不中断治疗,显著影响移植成功率。
02 马立巴韦片 在这样的背景下,马立巴韦片的问世为患者带来了新的希望。这种创新型口服抗病毒药物属于苯并咪唑核苷类药物,是全球首个靶向并抑制UL97蛋白激酶及其天然底物的抗病毒制剂。其独特的三重作用机制通过抑制CMV UL97蛋白激酶,可以有效抑制病毒DNA的复制、衣壳化和核逃逸,从而清除CMV血症并控制相关症状。 在TAK-620-303多中心Ⅲ期优效性研究中,马立巴韦展现出显著的临床效果。研究显示,马立巴韦治疗组的病毒清除率达到55.7%(131/235),而常规治疗组仅为23.9%(28/117),校正后差异达32.8%(P<0.001)。在安全性方面,马立巴韦组的中性粒细胞减少发生率仅为1.7%,远低于传统治疗组的25%;急性肾损伤发生率同样仅为1.7%,显著低于膦甲酸钠组的19.1%。 03 专利布局与仿制药挑战 马立巴韦持有多个专利 包括: 化合物专利:早期的专利如 WO2001044185A1(2001年申请)涵盖了苯并咪唑类化合物作为抗病毒剂的基本结构。后续的专利,如 WO2006012344A2,专注于特定取代基或立体异构体的优化,保护了该化合物的化学结构(苯并咪唑衍生物)。这些专利的保护期通常为 20 年,预计到 2021-2023 年到期,但可以通过专利期限延长(例如美国 PTE 政策)延续至 2026 年左右。 制剂专利:涉及马立巴韦片剂的配方,包含崩解剂和稳定剂等成分。例如,US20190046625A1(2019年申请)保护了口服固体制剂,预计有效期至 2040 年。 制备方法专利:专利如 US20150057245A1(2014年申请),涵盖了合成路线、关键中间体及纯化工艺,预计保护期至 2034 年左右。 适应症专利:包括针对耐药性CMV感染或特定人群(如移植患者)的治疗。例如,US20170360860A1(2017年申请)专门保护了治疗对更昔洛韦/缬更昔洛韦耐药的 CMV 感染,专利将持续到 2037 年左右。 仿制药风险与挑战 化合物专利到期后,仿制药企需规避制剂与适应症专利风险。原研可能通过次级专利(如晶型专利US20210002365A1)延长保护。国内企业可通过专利无效宣告或工艺优化突破限制,但需确保不侵犯用途专利。 04 市场表现
在市场表现方面,马立巴韦的发展势头强劲。自2021年11月获FDA批准上市以来,其全球销售额从2022年的105亿日元增长至2023年的191亿日元(约9.62亿元人民币)。
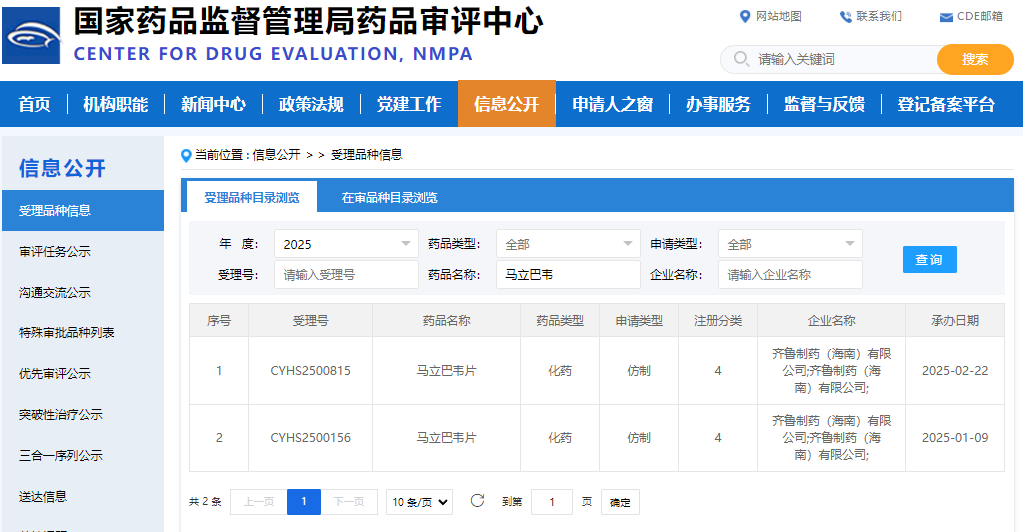
马立巴韦片已在美国、欧洲、韩国和澳大利亚获得孤儿药资格认定。2021年11月,马立巴韦被美国食品药品监督管理局(FDA)认定为首创药物并获批上市;2022年11月,获得欧盟委员会(EC)批准上市。 在中国,马立巴韦于2023年12月获国家药品监督管理局(NMPA)批准上市,并于2024年11月成功纳入国家医保乙类目录。 国内仿制药开发也在积极推进:2024年12月31日,奥赛康的4类仿制药马立巴韦片上市申请获得承办;2025年2月22日,齐鲁制药(海南)有限公司的4类仿制药申请获受理;此外,桂林南药也已提交了仿制药注册申请。首仿争夺战一触即发。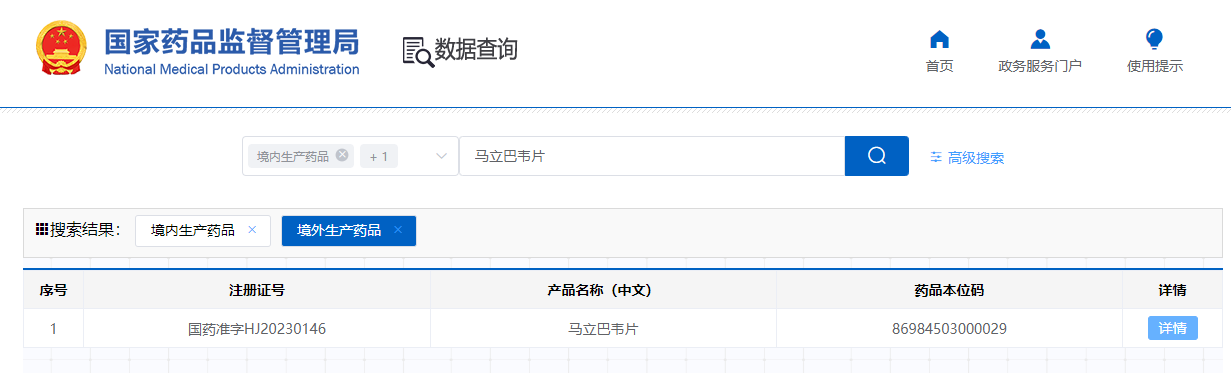
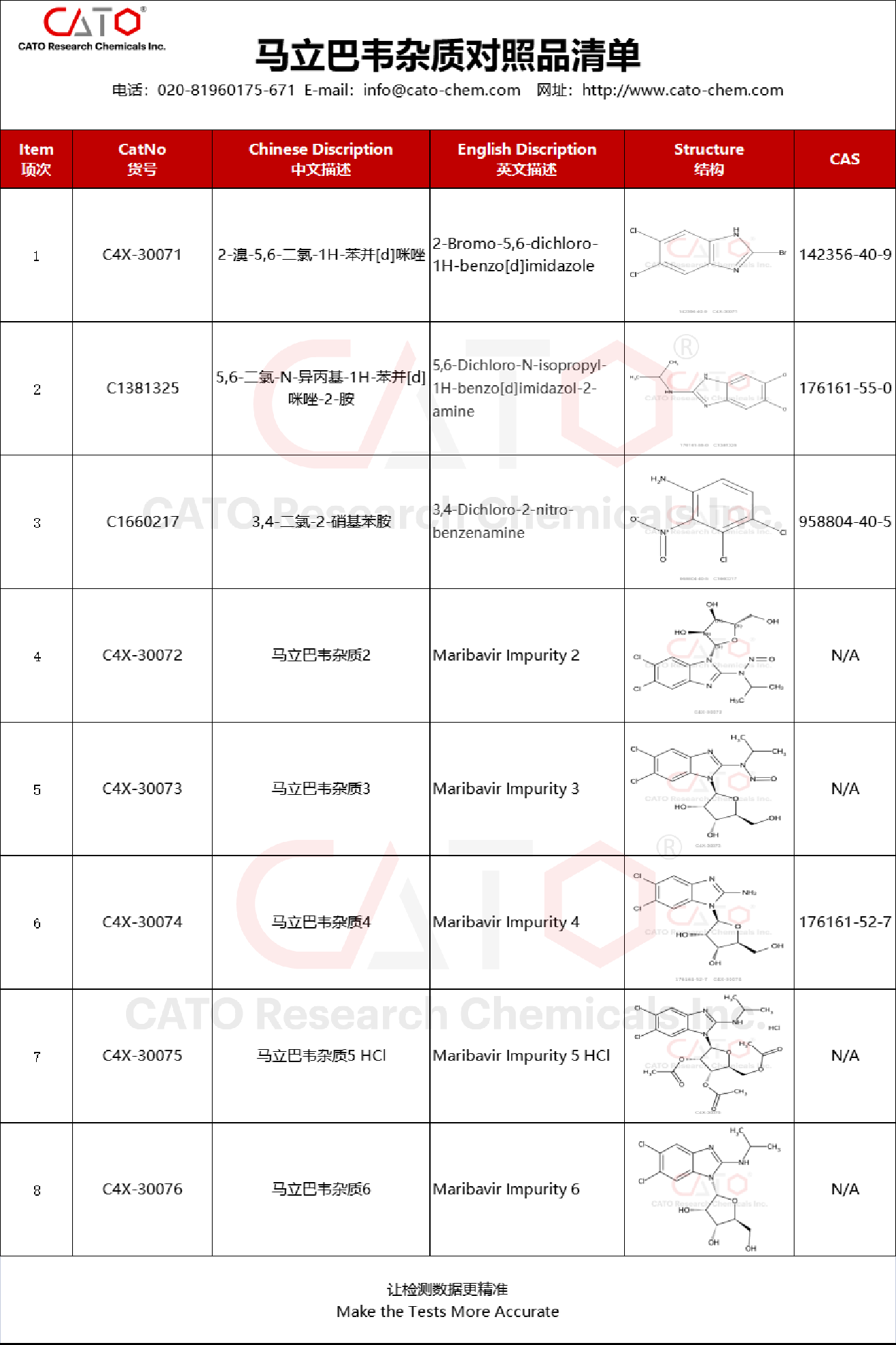
05 临床突破与未来展望 马立巴韦片的问世填补了移植后难治/耐药CMV治疗的临床空白。这款创新药物不仅显著提高了病毒清除率,还大大降低了治疗相关不良反应,已被纳入中国CSCO指南并获得II级推荐。随着该药物进入医保目录以及国内仿制药研发的推进,预计将进一步提升药物可及性,让更多患者获益。马立巴韦正在改变移植后CMV感染的治疗格局,为提高移植患者的生存率作出重要贡献。 马立巴韦杂质对照品 为支持马立巴韦仿制药的快速发展,CATO可提供马立巴韦杂质对照品,助力各研发机构开展仿制药研究和质量控制工作。