3.1一般杂质限度制定方法。
在ICHQ3A、Q3B的指导原则中,将杂质限度定义为:在特定水平下单个杂质或给定杂质谱的生物学安全性资料的获得和评价过程。该指导原则通过制定杂质的报告、鉴定和认证阈值监管杂质。杂质限度的确定首先要有充分的安全性依据,结合药物工艺路线,综合药学药理毒理及临床研究结果判定。其次,在排除为遗传毒性杂质的情况下,可综合考虑生产的可行性和产品的稳定性制定合理的杂质限度。杂质限度应考虑患者人群、每日剂量、给药途径、用药持续时间等因素。
3.2 遗传毒性杂质限度制定方法
近年来,遗传毒性杂质限度控制的法规逐步健全。2006年EMA公布了遗传毒性杂质限度指南的最终版。2008年底美国FDA发布了遗传毒性杂质指南草案,以及由美国药物研究和制造商协会(PhRMA)发布的PhRMA意见书。
ICH于2014年7月15日正式发布了《基因毒性杂质指南M7》,为遗传毒性杂质的鉴别、分类、定量分析和控制提出了切实可行的依据和方法,弥补EMA及FDA关于遗传毒性杂质控制指南在某些方面存在的不确定性和分歧。
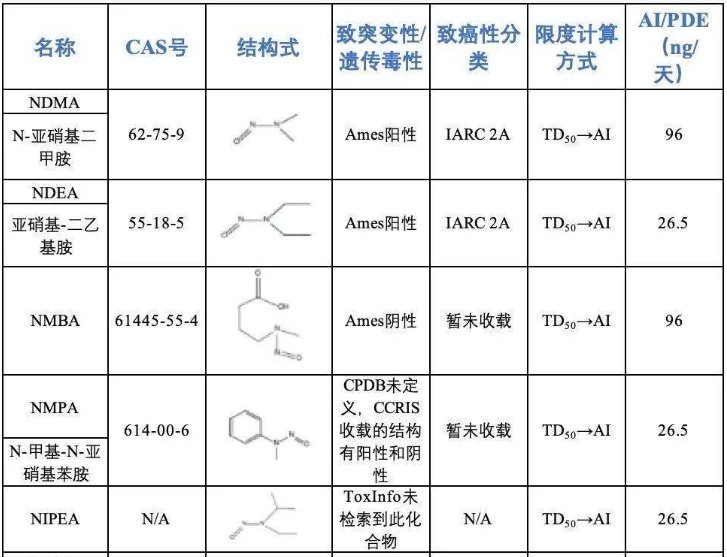
化学药物杂质研究是化药质量控制的重要方面,贯穿于整个药物研究过程。相信随着分析新技术的出现和应用以及我国药物质量控制标准更加严格规范化,药物杂质研究必将更加透彻,药物使用将更加安全有效。