1. 对于原料药,需依据所采用的具体合成工艺来分析在研产品中可能产生的杂质;
2. 基于产品的结构特征来分析可能产生的降解产物;
3. 对于制剂,可以通过主药与辅料/包材的相容性研究来分析产生的降解产物。
4. 通过强制降解试验来分析产品中潜在的降解产物。可考察样品在一定的酸、碱、高温、光照、氧化等因素影响下的降解产物。对于固体原料药,需分别考察在固体和溶液状态下的降解产物。必要时,可以根据情况进行以上因素综合存在时的强制降解试验。
5. 考察样品在确定的实际贮藏条件下所产生的降解产物。根据在研产品的性质,确定适宜的贮藏条件在稳定性研究中,考察产品在一定温度湿度、光线等实际保存、运输、使用过程中随时间产生的降解产物
欧洲药品管理局(EMA)建议“应基于扎实的科学评价,全面考虑参与合成的化学反应、原辅料中可能带人新原料药的杂质和可能的降解产物,确定最有可能在新药的合成、纯化和贮存期间出现的实际和潜在杂质”。
2015 年版《化学药物稳定性研究技术指导原则》明确了不同保存温度下的拟加速和长期稳定性试验方法,并在有效期的基础上提出了复检期。参照《中国药典》和《化学药物稳定性研究技术指导原则》,研究可能的降解产物和降解途径。
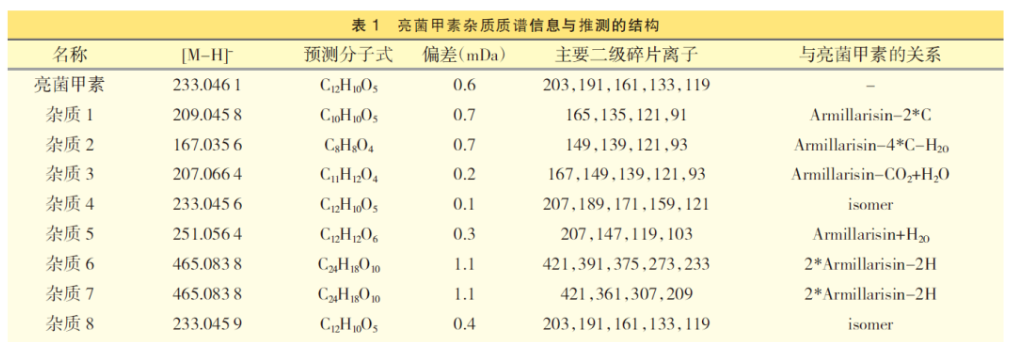
亮菌甲素注射剂中主要杂质LC-MS 分析